通过水平基因转移的寄生蜂杀死因子形成昆虫对寄生蜂的防御
2021年7月30日,东京农业技术大学、瓦伦西亚大学以及萨斯喀彻温省大学在Science上联合发表``Horizontally transmitted parasitoid killing factor shapes insect defense to parasitoids`一文。本文主要阐述昆虫是如何从病毒中受益来抑制体内寄生蜂的发育。病毒、寄生蜂和它们的昆虫宿主之间的这种三级营养关系反映了涉及竞争性生物的适应和反适应的进化军备竞赛。
寄生蜂在目标昆虫的身体和卵中产卵时,开发了许多的机制来克服其宿主的防御机制。本文主要描述了当宿主被一种表达赋予寄生蜂抗性的蛋白质的病毒感染时是如何进行反击的。当蝴蝶和飞蛾家族的成员成为寄生蜂的目标时,昆虫进化出一个基因家族,它由病毒水平携带--有时被纳入宿主基因组--并影响寄生蜂后代发育和羽化的能力。
在共享同一昆虫宿主的膜翅目寄生虫和昆虫病毒之间会发生生物不同界间的竞争。寄生蜂的幼虫随着被感染的宿主的死亡而死亡,或者由于对宿主资源的竞争而死亡。本文鉴定到了一个基因家族,即寄生蜂致死因子(pkf),它编码的蛋白质对腹茧蜂亚科的寄生蜂有毒害作用,并且决定了寄生的成功率。Pkfs在几个昆虫致病DNA病毒家族和一些鳞翅目动物基因组中被发现。证据表明,在昆虫痘病毒、昆虫囊泡病毒、杆状病毒和鳞翅目动物中发现的PKFs对寄生蜂具有同等和特定的毒性,其机制是在易感寄生蜂的细胞中引起细胞凋亡。突出了寄生蜂、病毒和它们的昆虫宿主之间的进化军备竞赛。
鳞翅目昆虫被寄生蜂广泛地利用作为产卵宿主。然而,鳞翅目昆虫也经常受到大型双链DNA(dsDNA)病毒的感染,包括杆状病毒、昆虫痘病毒(EPV)和昆虫囊泡病毒(AV)。杆状病毒和EPVs通过口腔感染,可以在鳞翅目宿主群体中迅速传播,而AVs是由雌蜂在产卵期间机械地从宿主传播到宿主。这些病毒群体的毒力范围包括从那些迅速导致死亡的病毒(alphabaculoviruses)到那些导致更长时间死亡的病毒(betabaculoviruses、EPVs和AVs)。对相同宿主资源的竞争导致DNA病毒和膜翅目寄生蜂之间生态位的重叠。这可能会推动不同的进化压力。事实上,对于共享类似或重叠的生态位和竞争资源的物种,种间竞争是十分常见的。然而,来自不同门类或不同界的物种之间的竞争并不十分清楚。
膜翅目寄生蜂和共享同一昆虫宿主的昆虫病毒之间的竞争是不同界间物种竞争的一个例子。昆虫病毒可能经历进化的压力,以规避宿主的免疫力,并尽量减少与寄生蜂对宿主资源的竞争。相比之下,不同的选择压力可能导致寄生蜂获得毒力因子或与病毒有共生关系,从而规避了宿主的抵抗力,使其能够适应新的宿主或避开寄生蜂的竞争对手。此外,鳞翅目动物的宿主可能进化出不同的防御机制。病毒、寄生蜂和它们的昆虫宿主之间的这种三级营养关系反映了涉及竞争性生物的适应和反适应的进化军备竞赛。这种进化可能反映了对水平基因转移(HGT)的选择,这是使相互作用的生物体之间的适合度能力迅速提高的机制之一。特别是病毒可以介导不同宿主之间的基因转移。
结果
MySEV对Cotesia kariyai的特异性致死作用及致死因子的研究
-
PKF蛋白发现在东方粘虫中,经口腔感染的昆虫痘病毒(EPV)的东方粘虫幼虫被C. kariyai(膜翅目:茧蜂科:腹茧蜂亚科)或Meteorus pulchricornis(膜翅目:茧蜂科:优茧蜂亚科)寄生。
-
C. kariyai在未受感染的幼虫中寄生是成功的;然而,MySEV感染抑制了寄生蜂的生长和生存。与MySEV感染有关的致命影响是C. kariyai特有的,因为M. pulchricornis的寄生性没有受到显著影响。
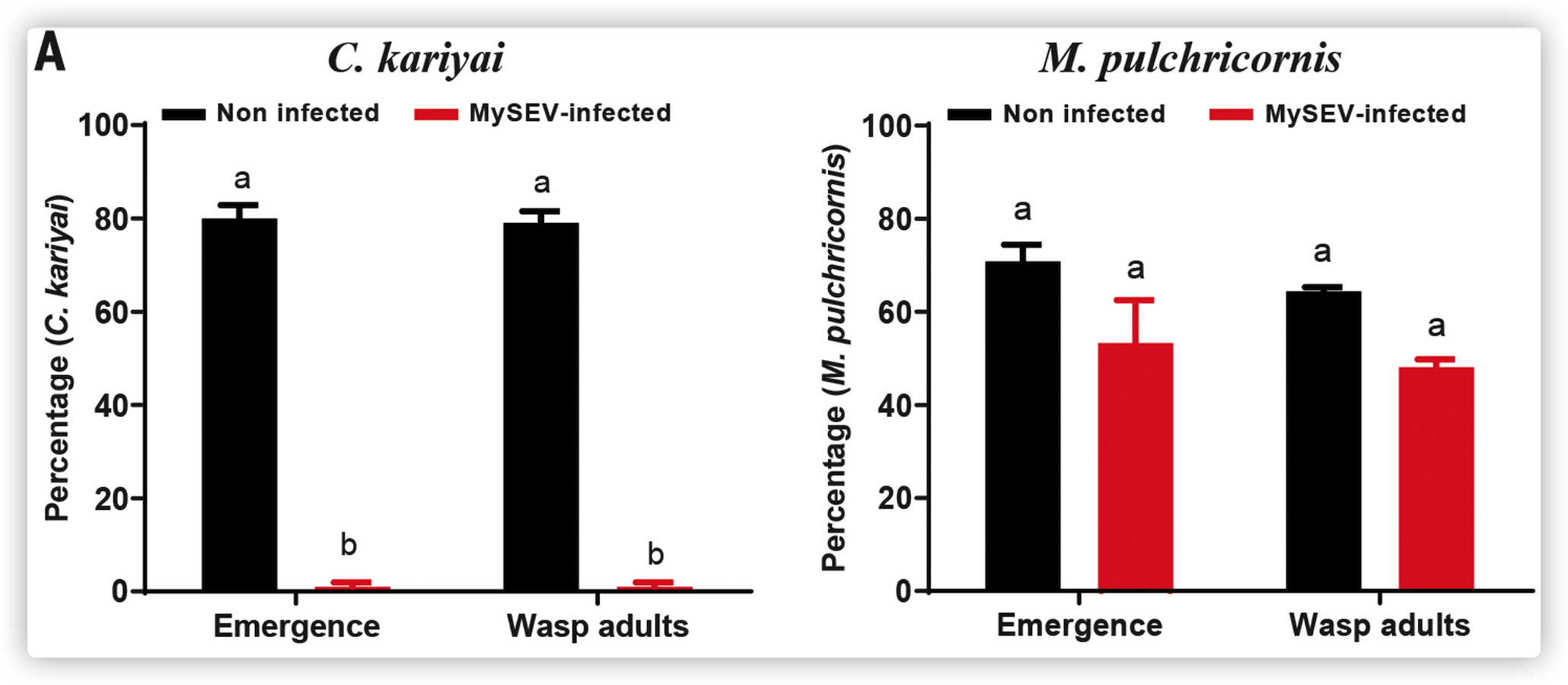
- 研究人员利用来自被感染的分离东方粘虫幼虫的无病毒体血浆(VFP)中证实了其对寄生蜂C. kariyai的体内杀伤活性,并证明其对体外培养的C. kariyai幼虫具有剂量依赖性的毒性
- 在MySEV感染菌幼虫的血淋巴中存在一种(或几种)因子,这种因子对腹茧蜂亚科的寄生蜂具有特异的毒性。
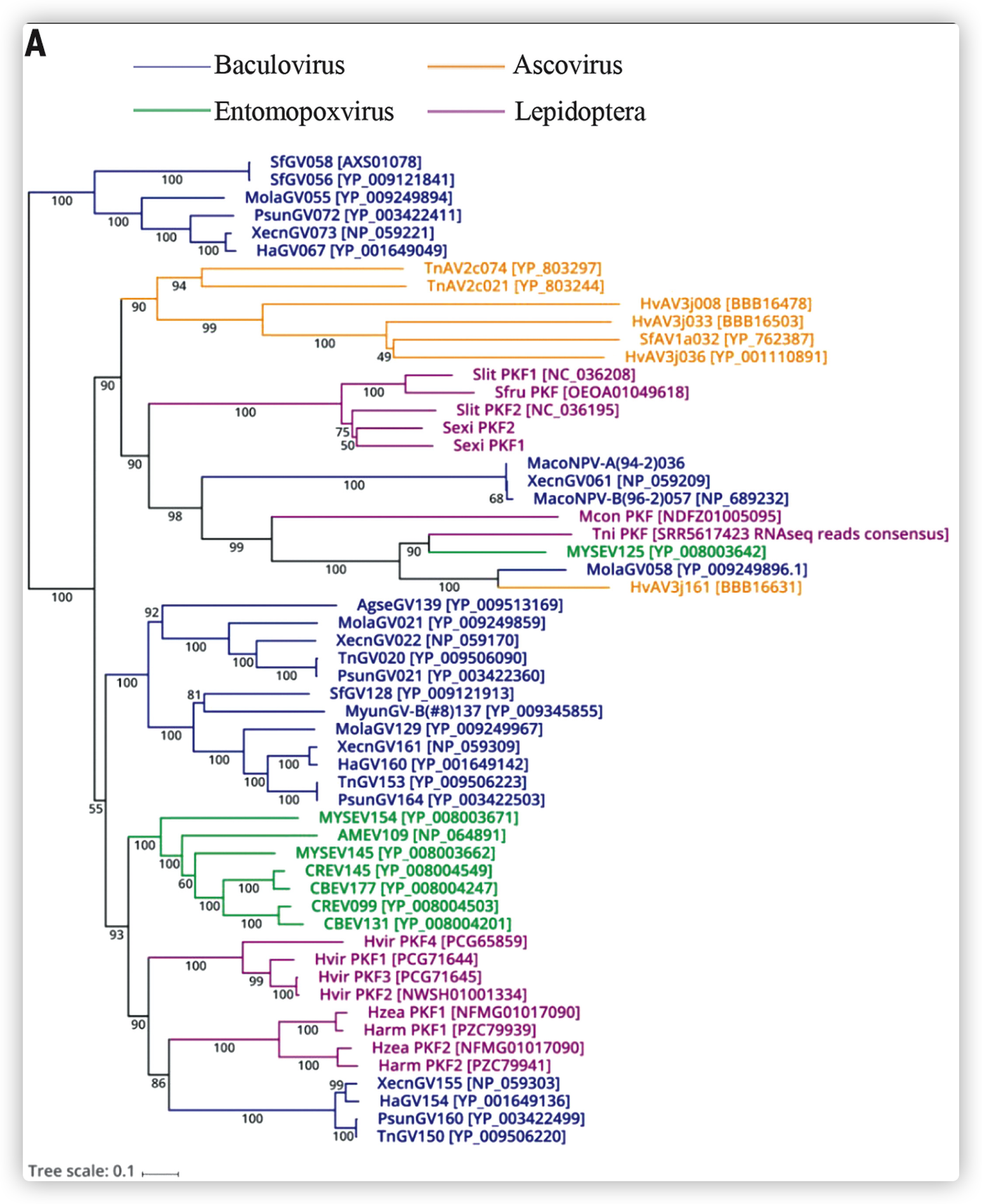
PKFs存在于其他病毒和昆虫物种中
- 同源搜索发现PKF在三组昆虫感染的dsDNA病毒中都有同源物。Ascoviridae、Baculoviridae和Entomopoxvirinae。值得注意的是,在非病毒物种中的同源搜索显示,在几个鳞翅目宿主中存在多个PKF同源物。
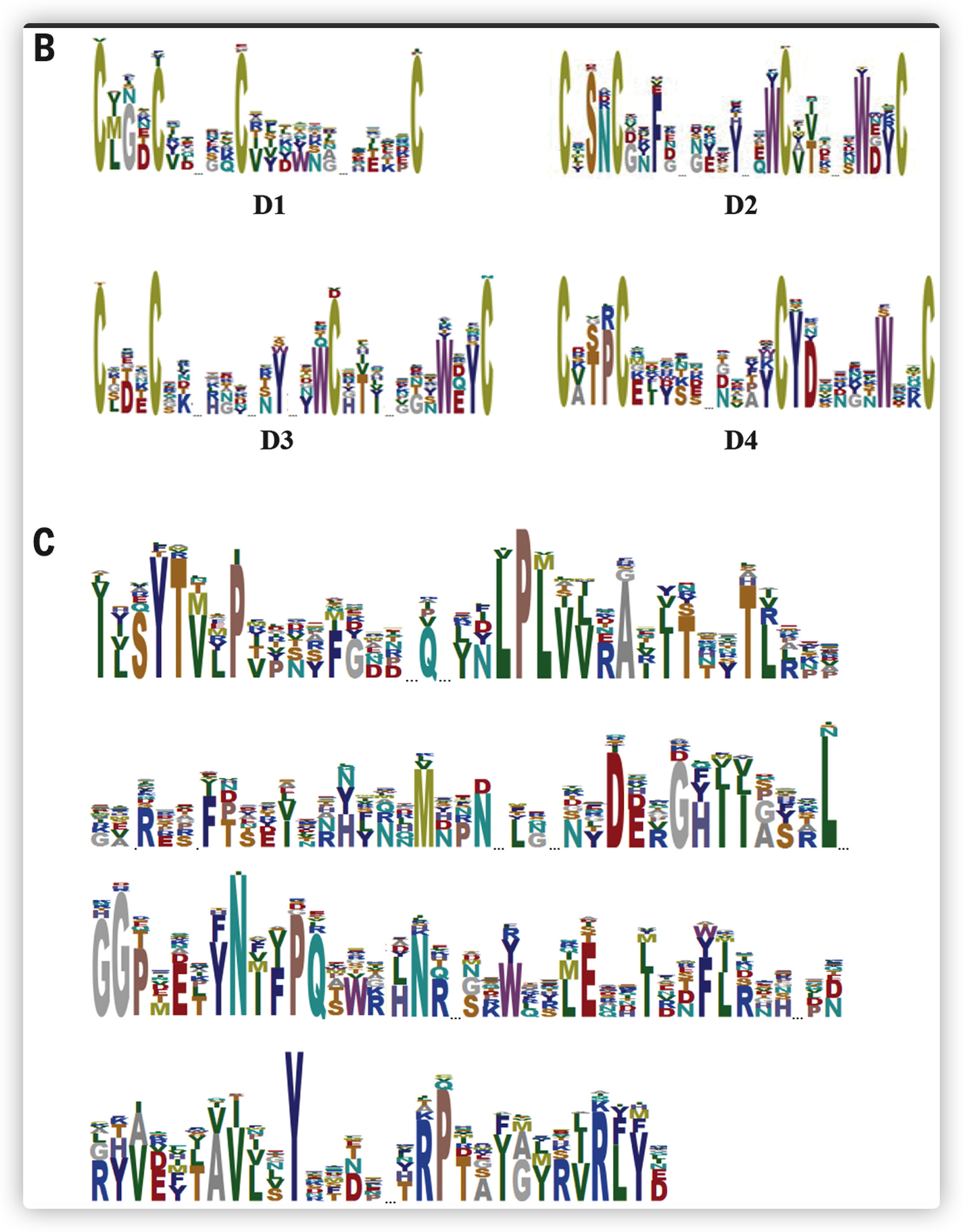
- 对比预测的氨基酸序列,发现所有的PKFs都有类似的主要结构,包括信号肽的存在,在N端区域有一系列保守的半胱氨酸结构(三到四个重复的CX3CX7-14CX8-13C结构),在蛋白质的C端有一个DNA/RNA非特异性内切酶结构(Pfam 13930 endonuclease_NS_2)。
- 鳞翅目动物的PKFs不在一个cluster中,这表明有多个基因转移事件。来自Helicoverpa和Heliothis物种的PKFs与betabaculovirus PKFs(PsunGV160、XecnGV155、HaGV154和TnGV150)关系更为密切。
- 多个PKFs似乎聚集在相关的betabaculovirus PKFs的不同支系中,这表明古老的基因复制和病毒之间的HGTs。
在AV中PKF活性是保守的
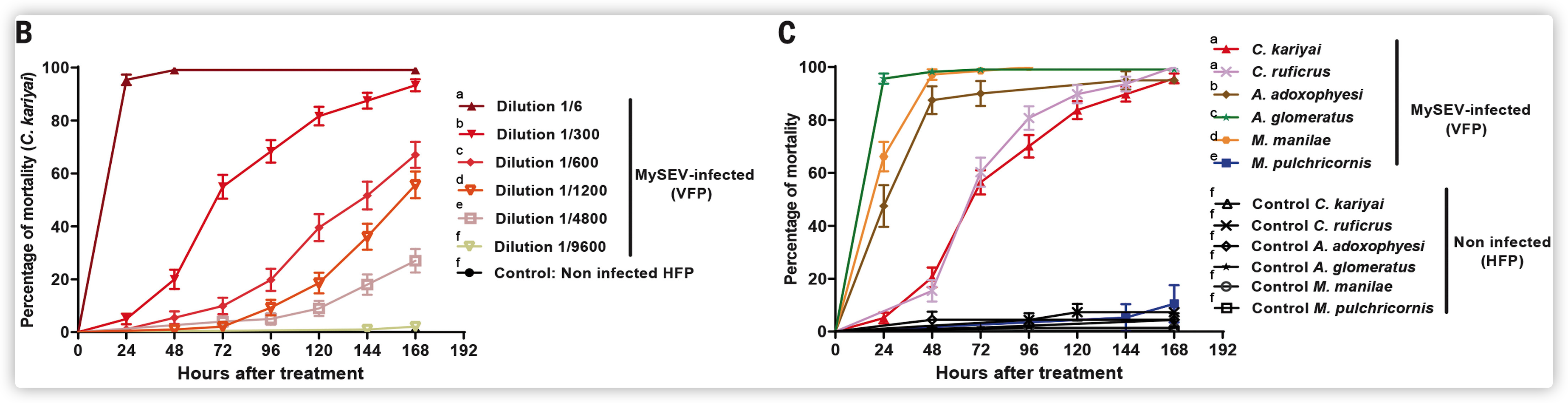
- HvAV-3j在东方粘虫幼虫中的感染抑制了C. kariyai的发育,但不影响M. pulchricornis在东方幼虫中的发育或羽化。
- HvAV-3j感染的VFP对腹茧蜂亚科寄生蜂C. kariyai和侧沟绿茧蜂幼虫有毒性,而斑痣悬茧蜂和齿唇姬蜂(膜翅目:姬蜂科)不受同一VFP影响。

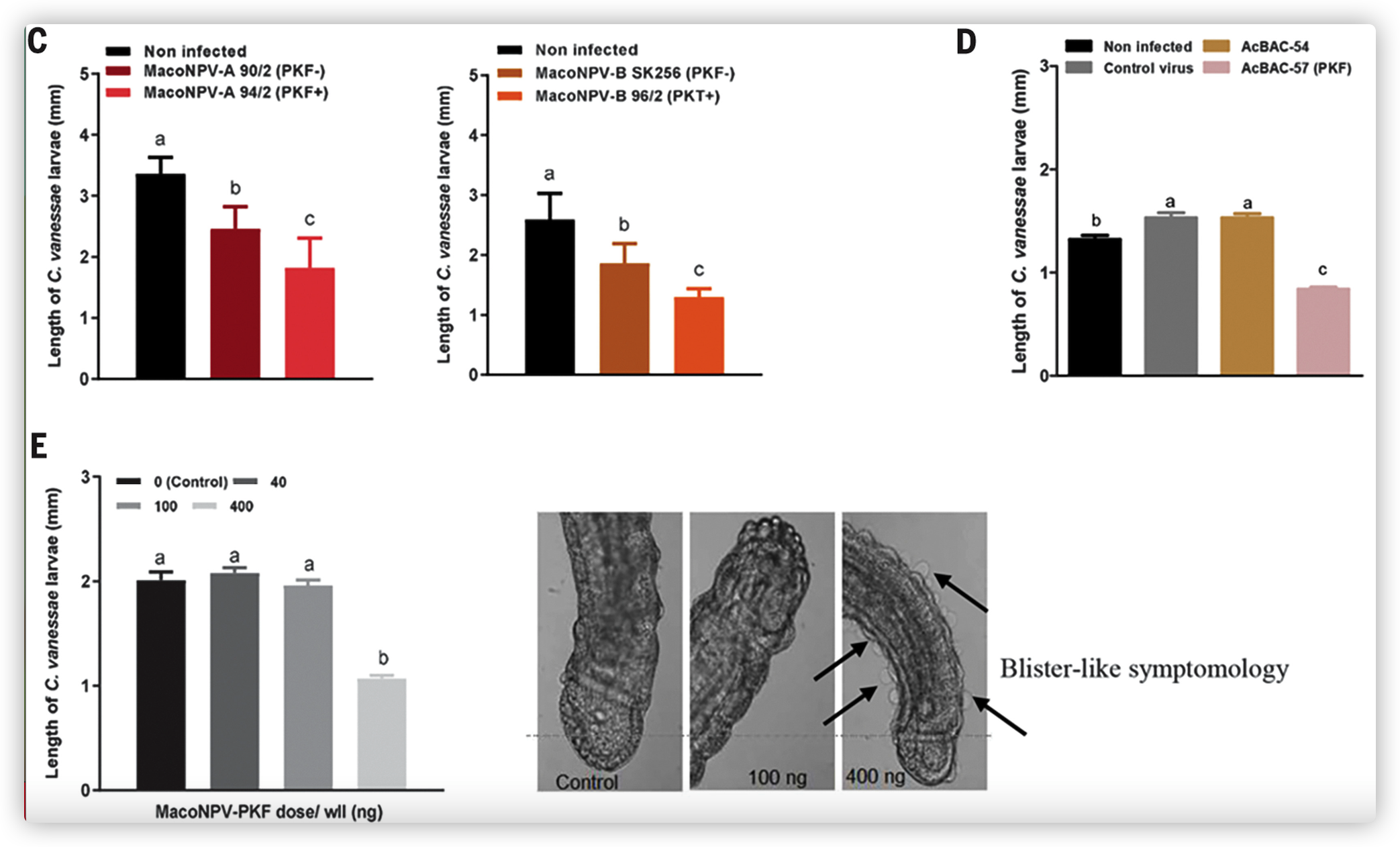
马氏核型多角体病毒(Mamestra configurata nucleopolyhedrovirus, MacoNPV)的PKFs对Cotesia vanessae具有负向影响
-
尽管感染MacoNPV-A株90/2或不携带pkf候选基因的MacoNPV-B株SK256,与未感染的对照组相比,导致寄生蜂幼虫体长降低,但携带pkf基因的株系(MacoNPV-A 94/2和MacoNPV-B 96/2)的观察效果明显更大。
-
宿主幼虫感染表达MacoNPV-B PKF(AcBAC-57)的重组噬菌体病毒后得到的寄生蜂幼虫明显比感染对照病毒(vAcMNPV-887)或表达ORF54(AcBAC-54)的同等重组噬菌体病毒的幼虫小(图3D),表明ORF57是对C. vanessae产生不利影响的原因。
-
MacoNPV-PKF(ORF57)的抑制活性通过用纯化的重组蛋白直接在体外孵化寄生蜂幼虫得到证实,这导致被处理的寄生蜂幼虫的发育以剂量依赖性减少。
-
在最高剂量下,C. vanessae幼虫没有生长,通常从处理后24小时开始在角质层上表现出 "水泡状 "症状,并显示出很少的运动或肠道蠕动。
甜菜夜蛾PKFs的活性和特异性
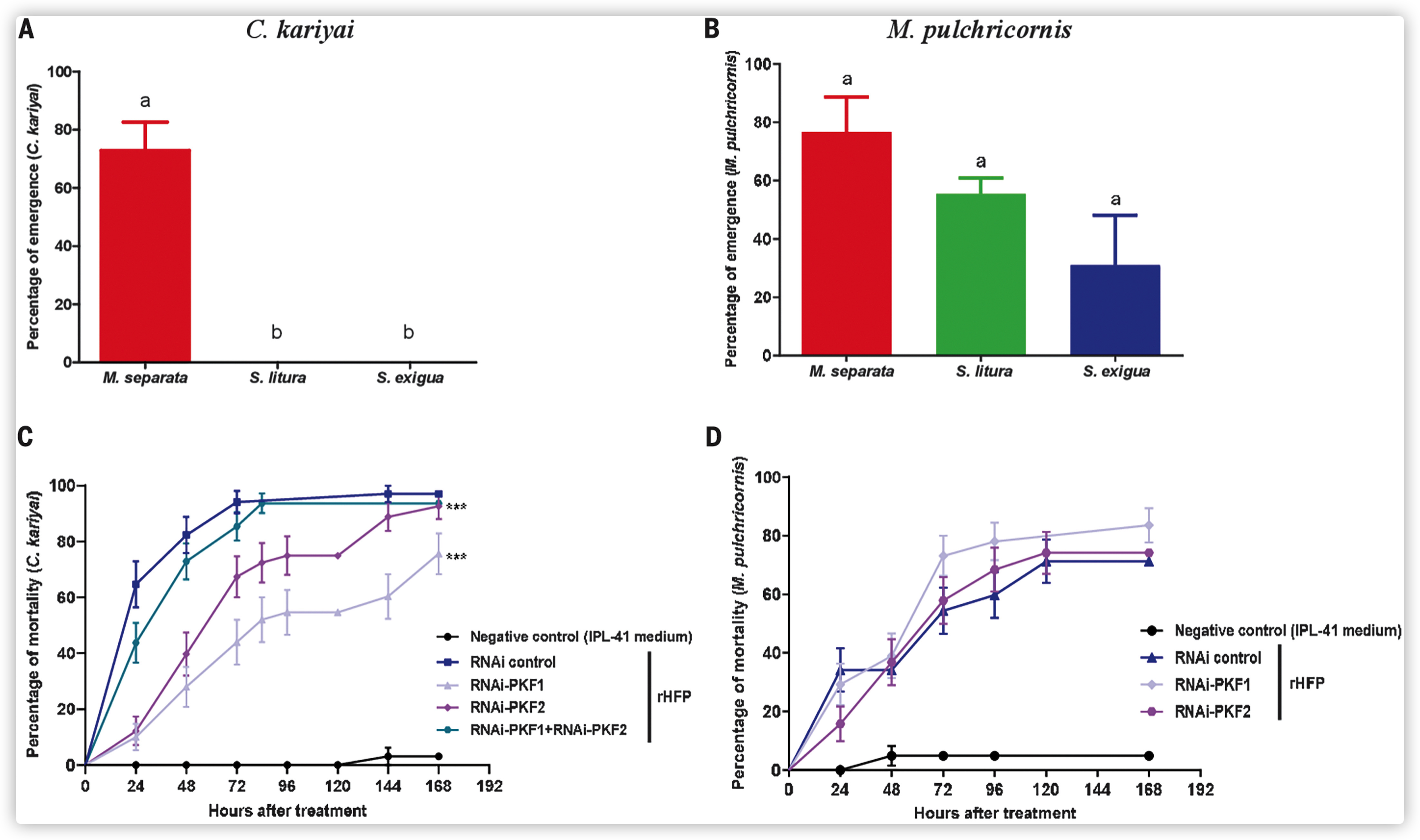
- 允许性试验显示,没有C. kariyai从斜纹夜蛾或斜纹夜蛾(其基因组中也有pkfs)中出现,而从东方粘虫中的羽化率为75%。
- 相比之下,寄生蜂斑痣悬茧蜂成功地从三个鳞翅目宿主中羽化。虽然没有得到显著的结果,但与东方粘虫相比,从甜菜夜蛾中的羽化率较低。
- 处理后七天,在IPL41培养基中,约100%的C. kariyai幼虫存活;然而,在甜菜夜蛾 rHFP存在的情况下,>90%的幼虫体外培养的幼虫死亡。
- 在甜菜夜蛾 rHFP存在的情况下,观察到寄生蜂M. pulchricornis幼虫的死亡率更有限。
- 通过RNA干扰(RNAi)敲除甜菜夜蛾 pkf1或pkf2的表达,可以确定甜菜夜蛾的致死活性是否取决于PKF的存在。在甜菜夜蛾 幼虫中pkf1或pkf2的基因沉默后,与对照组相比,在rHFP中体外培养的C. kariyai幼虫的存活率明显增加。
- 用来自经pkf1和pkf2 RNAi敲除处理的幼虫的等份rHFPs混合物处理C. kariyai幼虫,可将死亡率恢复到控制水平。考虑到该混合物包含的PKFs总浓度相当于来自pkf1或pkf2 RNAi敲除的幼虫的rHFPs中的浓度,结果表明两种PKFs具有协同活性。
- 在体外实验中,甜菜夜蛾pkf1或pkf2的沉默使得rHFP对斑痣悬茧蜂幼虫的死亡率没有影响,这表明甜菜夜蛾血淋巴对斑痣悬茧蜂幼虫的毒性与PKF活性无关。
PKFs可诱导易感寄生蜂凋亡
- 宿主东方粘虫 HFP在来自寄生蜂C. kariyai(CK1)或来自寄生蜂M. pulchricornis(MP4),MySEV感染的东方粘虫VFP在CK1细胞中引起DNA断裂,但在MP4细胞中没有。
- 所有经过处理的CK1细胞在12小时前都显示出凋亡的形态,而MP4细胞仍然健康。在用MySEV-VFP处理的CK1细胞中,通过增加caspase-3的活性也检测到了凋亡,caspase-3是凋亡途径中的一种信号分子(图5A)。在C. kariyai(图5C)的幼虫中检测到DNA碎片,但在M. pulchricornis(图5D)暴露于MySEV-VFP体外的幼虫中没有。

讨论
在几个昆虫感染的dsDNA病毒和鳞翅目宿主中发现的pkf基因的表达显示了对腹茧蜂亚科的寄生蜂的特殊毒性。这些PKF蛋白似乎形成了涉及病毒、寄生蜂和昆虫宿主的多级相互作用,病原体克服了与寄生蜂的竞争。PKFs在鳞翅目各物种中的存在,并且十分保守。夜蛾和病毒PKFs的系统发育分析和基因组分析表明,在两种病毒之间以及病毒与其鳞翅目宿主之间发生了多起基因复制和水平基因转移(HGT)事件,这突出了这些基因在调控病毒-蜂-昆虫宿主相互作用中的重要性。
PKF基因在不同的昆虫病原性大型dsDNA病毒中编码,如杆状病毒、昆虫痘病毒(EPV)和昆虫囊泡病毒(AV)。pkf基因使这些病毒在同一鳞翅目昆虫宿主内胜过腹茧蜂亚科寄生蜂,并赋予其优势,包括在同一鳞翅目宿主内增加病毒的后代产量。值得注意的是,一些鳞翅目昆虫已经获得了PKFs,而这些显然影响了能够在宿主体内的寄生蜂的生存。病毒-寄生蜂-鳞翅目宿主军备竞赛的驱动力不仅来自于天敌(昆虫病原病毒和寄生蜂)及其宿主的个体关系,而且还来自于基因转移,这些基因提供了特异性的武器来战胜竞争对手寄生蜂,并促进天敌和宿主之间的动态协同进化。
Reference
https://doi.org/10.1126/science.abb6396
